
Un equipo científico dirigido por José Antonio Sánchez Alcázar, de la U729 CIBERER en la Universidad Pablo de Olavide (UPO), continúa avanzando en sus investigaciones sobre la neurodegeneración con acumulación de hierro (NACH o NBIA por sus siglas en inglés), y en concreto sobre la neurodegeneración asociada a PLA2G6 (PLAN), uno de los 15 subtipos de este grupo de enfermedades raras que afectan principalmente a niños y niñas en su primera década de vida.
Así, un reciente estudio publicado en la revista internacional Neurobiology of Disease profundiza en el proceso patológico de la enfermedad de PLAN y en las posibles repercusiones de estos mecanismos para encontrar nuevas soluciones terapéuticas. Para ello, el equipo científico examinó la presencia de peroxidación lipídica, acumulación de hierro y disfunción mitocondrial en dos modelos celulares de PLAN, fibroblastos derivados de pacientes (células de la piel) y neuronas inducidas.
De esta manera, uno de los hallazgos más relevantes ha sido comprobar cómo la peroxidación lipídica que per se se establece en esta enfermedad, debido a la mutación, puede provocar acumulación de hierro, y que esta acumulación provoque a su vez peroxidación lipídica, creándose un círculo vicioso que agrava y hace progresar la enfermedad y la muerte de las neuronas. “Aunque la patogenia sigue siendo poco clara, la peroxidación lipídica, es decir, la degradación oxidativa de los lípidos, parece jugar un papel central en esta dolencia para la que actualmente no hay cura y cuya clínica es muy grave, pues se caracteriza por pérdida de visión, del control muscular o de las habilidades intelectuales y atrofia cerebelosa”, explica el Dr. Sánchez Alcázar, profesor del Departamento de Fisiología, Anatomía y Biología Celular de la UPO.
Vitamina E: correctora de la fisiopatología
Gracias a la comprensión de estos mecanismos patológicos, el equipo de investigación ha presentado otro hallazgo relevante: las características patológicas fueron revertidas con vitamina E.
“Observamos cómo los antioxidantes de la membrana celular como la vitamina E pueden bloquear este círculo vicioso que se produce por la peroxidación lipídica y la acumulación de hierro, pudiendo aliviar así muchas de las alteraciones que llevan a la muerte neuronal”, declara Sánchez Alcázar.
Las principales alteraciones patológicas se corrigieron así mediante la suplementación con vitamina E en ambos modelos, tanto en los fibroblastos PLAN como en las neuronas inducidas, lo que sugiere que el bloqueo de la progresión de la peroxidación lipídica es un objetivo terapéutico crítico.
El equipo científico da de esta manera un paso más en la investigación de esta enfermedad rara, una investigación que tiene numerosas repercusiones. “El estudio de esta enfermedad es importante no únicamente para conocer la neurodegeneración asociada a PLA2G6 y encontrar así soluciones terapéuticas, va más allá, pues se trata de un modelo con el que también podemos estudiar la neurodegeneración que ocurre en otras patologías NACH, el envejecimiento y en otras enfermedades más frecuentes como Alzhéimer y Parkinson”, sostiene Sánchez Alcázar.
En este trabajo el equipo de Sánchez Alcázar ha colaborado estrechamente con los catedráticos de la UPO José A. Armengol y Antonio Rodríguez Moreno, y el científico titular del Instituto de la Grasa-CSIC, Joaquín J. Salas.
Proyecto BrainCure
Las NACHs son un grupo de trastornos neurológicos hereditarios en los que el hierro se acumula en los ganglios basales, lo que produce distonía progresiva, espasticidad, parkinsonismo, anomalías neuropsiquiátricas, atrofia óptica o degeneración de la retina, y a menudo la muerte temprana de los afectados.
Desde que se pusiera en marcha el Proyecto BrainCure en el año 2014, el equipo del profesor de la UPO José Antonio Sánchez Alcázar, que desarrolla su trabajo en el Centro Andaluz de Biología del Desarrollo (CABD, centro mixto de la UPO, CSIC y Junta de Andalucía), ha logrado grandes avances en el estudio de estas enfermedades. Estos científicos y científicas proponen una visión ambiciosa y adaptada al nuevo concepto de medicina personalizada. Así, su trabajo se centra en evaluar la efectividad terapéutica de los distintos tratamientos en los fibroblastos derivados de los pacientes y en células neuronales generadas por reprogramación directa.
De esta manera, los resultados obtenidos en el laboratorio con modelos celulares de los propios pacientes, que luego se están trasladado a la clínica con resultados muy prometedores en el subtipo NACH llamado PKAN (el más prevalente de los subtipos), ha llevado a aplicar la misma metodología a los demás subtipos NACH con resultados también alentadores a nivel de laboratorio.
En la actualidad el Proyecto BrainCure está realizando medicina de precisión en los 5 subtipos más frecuentes: PKAN, neurodegeneración asociada a pantotenato kinasa, con mutaciones en el gen PANK2; PLAN, neurodegeneración asociada a PLA2G6, con mutaciones en el gen PLA2G6; BPAN, neurodegeneración asociada a la proteína beta-propeller, con mutaciones en el gen WDR45; MPAN, neurodegeneración asociada a la proteína de la membrana mitocondrial, con mutaciones en el gen C19orf12; y FAHN, neurodegeneración asociada a la hidroxilasa de ácidos grasos, con mutaciones en el gen FA2H.
El equipo científico está realizando actualmente medicina personalizada en más de 40 pacientes procedentes de España y otros países como Brasil, Colombia, México, EEUU, Francia, Reino Unido, Holanda, Hungría y Polonia.
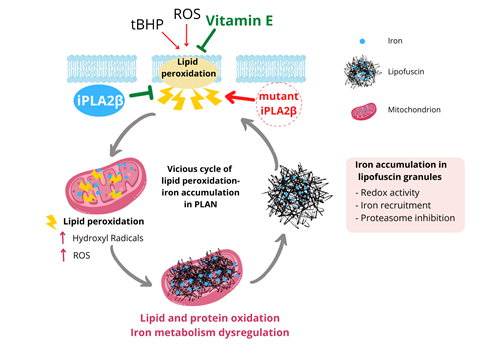
Explicación de la imagen: El circulo vicioso de la neurodegeneración:
La peroxidación lipídica provoca acumulación de hierro y esta, a su vez, induce peroxidación lipídica.
Artículo de referencia:
Irene Villalón García, Mónica Álvarez Córdoba, Suleva Povea Cabello, Marta Talaverón Rey, Marina Villanueva Paz, Raquel Luzón Hidalgo, Juan M. Suárez Rivero, Alejandra Suárez Carrillo, Manuel Munuera Cabeza, Joaquín J. Salas, Rafael Falcón Moya, Antonio Rodríguez-Moreno, José A. Armengol, José A. Sánchez Alcázar. “Vitamin E prevents lipid peroxidation and iron accumulation in PLA2G6-Associated Neurodegeneration”. (2022). Neurobiology of Disease.
https://doi.org/10.1016/j.nbd.2022.105649