
En humanos existen más de 50 transportadores de aminoácidos diferentes, responsables de la incorporación de aminoácidos en la célula y de regular el balance de estas moléculas entre el exterior y el interior celular. Mutaciones en estos transportadores se han asociado con diferentes patologías, pero, a pesar su importancia, aún conocemos poco sobre como funcionan. Científicos del Instituto de Investigación Biomédica (IRB Barcelona) y del Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) han caracterizado la estructura de uno de lostransportadores de la familia LAT.
Los transportadores LAT son una familia que engloba diferentes transportadores de aminoácidos, presentes incluso en bacterias. Mutaciones en los transportadores LAT se asocian con enfermedades tan diversas como el autismo, la perdida auditiva relacionada con la edad o la cistinuria.
Este estudio, publicado en la revista Nature Communications, se ha centrado en BasC, un transportador LAT presente en bacterias. “Hemos utilizado BasC como modelo ya que es similar tanto estructural como funcionalmente a los transportadores LAT humanos”, señala Manuel Palacín, líder del laboratorio de Transportadores de Aminoácidos y Enfermedad del IRB Barcelona y jefe de grupo del CIBERER.
Gracias a la estructura y el análisis funcional de BasC, los primeros autores de este trabajo, Ekaitz Errasti-Murugarren, Joana Fort y Paola Bartoccioni, investigadores postdoctorales del IRB Barcelona y del CIBERER, han conseguido identificar el sitio de unión de los aminoácidos en los transportadores LAT, cómo se produce la interacción entre ambos y las regiones claves del transportador para que se produzca dicha unión.
“Saber cómo los transportadores LAT reconocen a los aminoácidos que deben introducir en la célula, nos permite comprender mejor su funcionamiento y nos ayuda a descifrar los defectos moleculares asociados a diferentes patologías para poder desarrollar posibles tratamientos”, comenta Palacín, también catedrático de la Universidad de Barcelona.
En esta colaboración entre el IRB Barcelona, el CIBERER, el IBMB-CSIC y el Centro Nacional de Supercomputación, se ha caracterizado la estructura de BasC mediante cristalografía de rayos X utilizando un anticuerpo para este transportador. “Los anticuerpos para BasC que desarrollamos resultaron ser excelentes herramientas para estudiar su funcionamiento” añade Palacín.
El estudio ha contado con la financiación del Ministerio de Ciencia, Innovación y Universidades, La Fundació La Marató TV3, SIDRA Medicine (Qatar), CIBERER, la Generalitat de Catalunya, INSTRUCT (European Strategy Forum on Research Infrastructures, ESFRI) y Hercules Foundation Flanders.
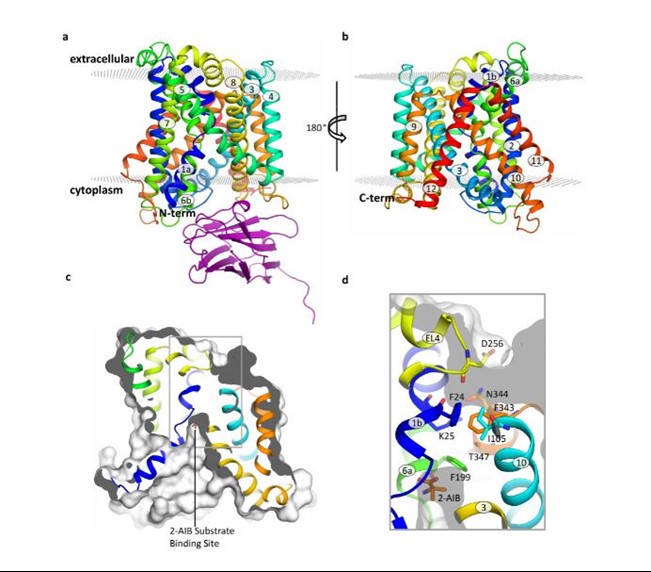
Imagen: Estructura del transportador BasC.
Artículo de referencia:
L-Amino acid Transporter structure and molecular bases for the asymmetry of substrate interaction.Ekaitz Errasti-Murugarren, Joana Fort, Paola Bartoccioni, Lucía Díaz, Els Pardon, Xavier Carpena, Meritxell Espino-Guarch, Antonio Zorzano, Christine Ziegler, Jan Steyaert, Juan Fernández-Recio, Ignacio Fita and Manuel Palacín.Nature Communications (2019) doi:10.1038/s41467-019-09837-z