La activación de las células progenitoras hepáticas, denominadas células ovales en roedores, se ha relacionado con el daño de los hepatocitos en enfermedades hepáticas crónicas, incluida la enfermedad hepática metabólica (MAFLD). Sin embargo, la plasticidad de dichas células puede verse afectada en entornos patológicos.
Un nuevo estudio del grupo de CIBERDEM que lidera Angela Mª Martínez Valverde en el Instituto de Investigaciones Biomédicas Alberto Sols ha aportado nuevos resultados sobre los procesos moleculares y celulares involucrados en la susceptibilidad de las células ovales a la lipotoxicidad, así como el papel del gen Ptpn1, que codifica para la proteína tirosina fosfatasa 1B (PTP1B) en este proceso. Resultados anteriores ya mostraron una protección frente a distintos estímulos de muerte celular en los hepatocitos mediante la inhibición de la proteína PTP1B. El trabajo ha contado con la colaboración los laboratorios de Jesús Balsinde, también de CIBERDEM, y con los grupos de CIBEROBN de Laura Herrero y Mª Jesús Moreno-Aliaga y el investigador del CIBEREHD Carmelo García-Monzón.
“Estos resultados podrían abrir nuevas perspectivas terapéuticas para asegurar la viabilidad y plasticidad de las células progenitoras del hígado en situaciones de daño hepático lipotóxico como el que ocurre en la MAFLD” explica la jefa de grupo del CIBERDEM Ángela Mª Martínez Valverde. Los resultados se han publicado en Cell Death and Differentiation.
El equipo de investigación mostró cómo el tratamiento con ácido palmítico indujo la muerte celular por apoptosis en las células ovales hepáticas, proceso que ocurría en paralelo a procesos celulares claves como estrés oxidativo, disfunción mitocondrial y un bloqueo del flujo autofágico. Sin embargo, este efecto lipotóxico estaba muy atenuado en las células ovales aisladas de ratones Ptpn1-/- que mostraron aumentos en la expresión de genes antioxidantes y en la vía de señalización de respuesta a proteínas mal plegadas, así como un mayor contenido de retículo endoplásmico y una elevación en la expresión y actividad del enzima estearoil CoA desaturasa (SCD1) que se reflejaba en el perfil lipidómico.
“Los efectos protectores en las células ovales Ptpn1-/- concurrieron con una autofagia muy activa, una mayor actividad mitocondrial y una reprogramación metabólica caracterizada por una firma molecular del estado de ayuno, lo que favorecía la formación de gotas lipídicas como un mecanismo protector frente a la lipotoxicidad inducida por el ácido palmítico” explica Inés Barahona, investigadora del IIB Alberto Sols y CIBERDEM y primera autora de la publicación.
Además, añade, “el bloqueo de la autofagia en las células ovales Ptpn1-/- redujo la expresión y actividad de la SCD1, la actividad mitocondrial, impidió la formación de gotas de grasa y restauró la lipoapoptosis, un efecto también recapitulado por la inhibición de la SCD1”.
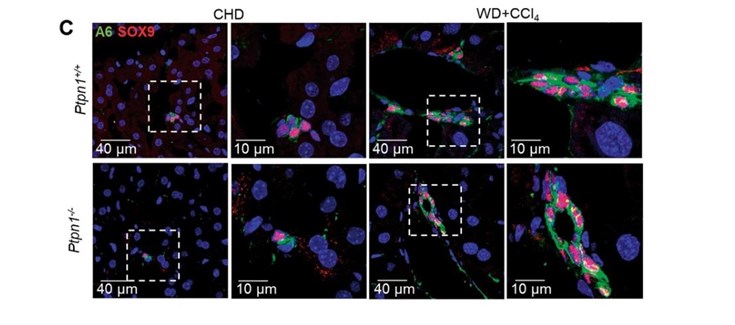
El análisis detallado de las células ovales Ptpn1-/- tratadas con ácido palmítico mediante microscopía confocal in vivo demostró una interacción dinámica las gotas lipídicas con los lisosomas, lo que probablemente asegura el reciclaje de lípidos para mantener la carga energética necesaria para la formación de las gotas lipídicas. Las autoras subrayan que en los hígados de ratones Ptpn1-/-, sometidos a un protocolo experimental de MAFLD, se encontraron células ovales que contenían gotas lipídicas, lo que abre una nueva perspectiva terapéutica para preservar la proliferación de estas células bajo daño hepático crónico, pero favoreciendo su plasticidad.
Artículo de referencia:
Barahona, I., Rada, P., Calero-Pérez, S. et al. Ptpn1 deletion protects oval cells against lipoapoptosis by favoring lipid droplet formation and dynamics. Cell Death Differ (2022). https://doi.org/10.1038/s41418-022-01023-x