Un trabajo colaborativo de varios grupos de investigación europeos en el que han participado activamente Araceli del Arco y otros investigadores de las unidades U743 y U753 CIBERER, lideradas respectivamente por Jorgina Satrústegui en la Universidad Autónoma de Madrid y Pablo Lapunzina en el Hospital La Paz, ha descubierto que mutaciones en el transportador de nucleótidos mitocondrial SCaMC-1/SLC25A24 causan el síndrome de Fontaine.
Se trata de un síndrome progeroide muy poco frecuente caracterizado por un retraso prenatal y postnatal del crecimiento, la disminución de los depósitos de grasa subcutánea, defectos en la fontanela anterior, craneosinostosis y alteraciones en las falanges distales de manos y pies. Además, los afectados presentan un fenotipo facial distintivo y muerte prematura, alrededor del primer año de vida en la mitad de los casos. Los primeros afectados por el síndrome de Fontaine se describieron hace 40 años pero no se conocía su causa genética.
En este estudio, se han analizado muestras de 4 casos, procedentes de diferentes regiones europeas y diagnosticados como afectados por el síndrome de Fontaine, mediante análisis de exoma completo. Los resultados del estudio, publicado en American Journal of Human Genetics, indican la presencia en todos los individuos afectados de una mutación dominante originada de novo que afecta en todos los casos al mismo aminoácido, Arg217, de SCaMC-1/SLC25A24, el transportador mitocondrial de ATP-Mg/Pi. Este transportador realiza el transporte de ATP-Mg a la mitocondria, para el mantenimiento de los niveles óptimos de nucleótidos de adenina en la matriz mitocondrial. SCaMC-1/SLC25A24 se encuentra en altos niveles en tumores pero no había sido relacionado hasta ahora con otras patologías.
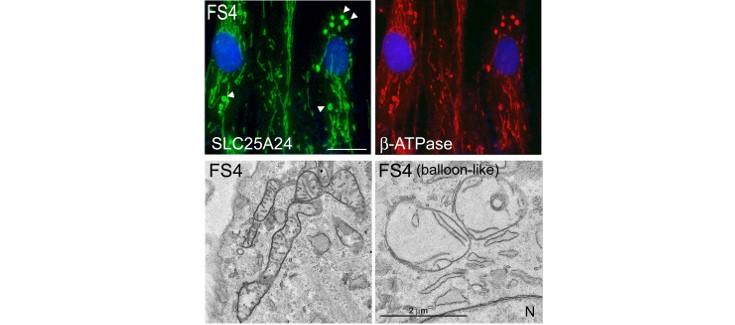
El hallazgo es relevante pues involucra mutaciones en una proteína mitocondrial con un síndrome progeroide. Aunque no se ha esclarecido completamente su relación con el fenotipo observado, los análisis estructurales realizados in silico han mostrado que las mutaciones en Arg217 provocan cambios conformacionales en SLC25A24 que podrían alterar el correcto funcionamiento mitocondrial. Así los resultados obtenidos en fibroblastos de pacientes y en líneas celulares indican que las mutaciones en SCaMC-1/SLC25A24 alteran la morfología mitocondrial y provocan una disminución de la tasa de proliferación celular. Cuando se expresan en líneas celulares, las mutaciones en SLC25A24 disminuyen la síntesis mitocondrial de ATP, provocando hiperpolarización mitocondrial y un aumento de la fuga de protones, indicativos de un deterioro del metabolismo energético.
En paralelo, otro grupo multidisciplinar europeo liderado por Uwe Kornak, de la Universidad de Berlín, ha encontrado la misma mutación en SCaMC-1/SLC25A24 en una cohorte diferente de pacientes. Ambos trabajos se han publicado en el mismo volumen de American Journal of Human Genetics.
De Novo Mutations in SLC25A24 Cause a Disorder Characterized by Early Aging, Bone Dysplasia, Characteristic Face, and Early Demise. (2017) Writzl K, Maver A, Kovačič L, Martinez-Valero P, Contreras L, Satrustegui J, Castori M, Faivre L, Lapunzina P, van Kuilenburg ABP, Radović S, Thauvin-Robinet C, Peterlin B, Del Arco A, Hennekam RC. American Journal of Human Genetics. 101:844-855. doi: 10.1016/j.ajhg.2017.09.017.
* Pie de foto: En fibroblastos de pacientes de síndrome de Fontaine (FSP) la presencia de la variante patogénica p.Arg217His de SCaMC-1/SLC25A24 altera la morfología mitocondrial. En estas células se detectan mitocondrias hinchadas cerca del núcleo, tanto mediante inmunofluorescencia utilizando anticuerpos contra proteínas mitocondriales como utilizando microscopia electrónica. Estas mitocondrias presentan crestas mitocondriales alteradas.